Esami accurati per la valutazione dei fattori di rischio e scelta delle terapie idonee
Il Dietologo Nutrizionista Clinico Dott. D'Andrea Federico, medico specialista in alimentazione, valuta con attenzione terapie e fattori di rischio per la salute, aiutando i suoi pazienti a ritrovare il peso forma o scongiurare complicazioni in modo naturale e sicuro. La riduzione di peso, soprattutto quando eccessivo, ha infatti notevoli benefici su tutto l’organismo, ma richiede forza di volontà e impegno al fine di cambiare le abitudini quotidiane dannose.
Affidarsi a un professionista che studierà una dieta personalizzata assicura anche un effetto e un beneficio duraturi nel tempo.
Obesità come fattore di rischio
Terapie e fattori di rischio rappresentati dall’obesità sono oggi molto conosciute, grazie alla promozione di uno stile di vita più sano e una maggiore informazione sulle conseguenze di determinati comportamenti alimentari.
L’obesità è infatti causa principale di malattie cardiovascolari, ictus, diabete, malattie della colecisti, osteoartriti e alcuni tumori (endometriale, colon rettale, renale, della colecisti e della mammella in post-menopausa).
- Altri fattori di rischio
Altri problemi di salute associati a un eccesso di peso corporeo sono ipertensione, ipercolesterolemia, apnea notturna e problemi respiratori, asma, aumento del rischio chirurgico, complicanze in gravidanza, irsutismo e irregolarità mestruali.
Un problema particolarmente grave è quello dell’insorgenza dell’obesità tra bambini ed adolescenti, esposti fin dall'età infantile a difficoltà respiratorie, problemi articolari, mobilità ridotta, ma anche disturbi dell'apparato digerente e di carattere psicologico.
Inoltre, chi è obeso in età infantile lo è spesso anche da adulto: aumenta quindi il rischio di sviluppare precocemente fattori di rischio di natura cardiovascolare (ipertensione, malattie coronariche, tendenza all'infarto) e condizioni di alterato metabolismo, come il diabete di tipo 2 o l’ipercolesterolemia.
- L’indice di massa corporea
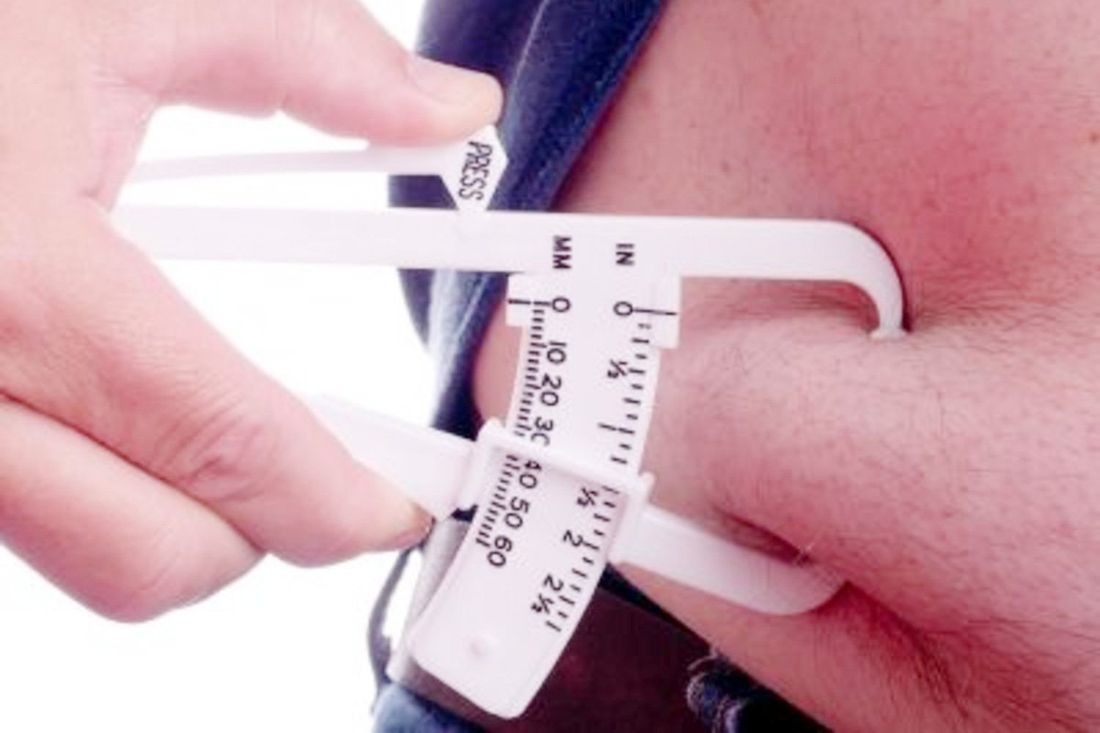
L’obesità è definita come un eccesso di grasso corporeo in relazione alla massa magra, in termini sia di quantità assoluta, sia di distribuzione in punti precisi del corpo. La distribuzione del grasso corporeo può essere effettuata con diversi metodi, dalla misura delle pieghe della pelle, al rapporto tra la circonferenza della vita e dei fianchi, o con tecniche più sofisticate come gli ultrasuoni, la Tac o la risonanza magnetica.
La classificazione della popolazione in base al peso viene fatta utilizzando l’indice di massa corporea (Bmi = body mass index, secondo la definizione americana), considerato il più rappresentativo della presenza di grasso corporeo in eccesso. Il Bmi si calcola secondo la formula seguente: Bmi = peso (in kg)/quadrato dell’altezza (in metri).
Le classi di peso indicate dal Bmi sono: 30 obesità.
Esistono naturalmente delle differenze legate al sesso: a parità di Bmi, le donne tendono ad avere più grasso corporeo rispetto agli uomini, così come gli anziani rispetto ai giovani. Inoltre, chi ha un fisico sportivo potrà pesare di più proprio grazie alla massa muscolare molto sviluppata, ma non rientrare per questo nella categoria sovrappeso o obesità.
- Prevenzione e trattamento
Nel caso dell’obesità, il trattamento principale è la prevenzione: adottando stili di vita sani, grazie cioè a un’alimentazione corretta e a un’attività fisica adeguata, si può controllare il proprio peso ed evitare che superi i livelli a rischio.
Nella diagnosi di obesità, e soprattutto in tutte le successive terapie e trattamenti dietologici, è necessario evitare autodiagnosi, ma affidarsi a uno specialista. Il trattamento consiste nella riduzione del peso corporeo, sotto stretto controllo medico e spesso presso centri specializzati, e nel mantenimento di un peso adeguato alla propria altezza grazie a un’alimentazione corretta. Accanto alla dieta, spesso studiata anche sui casi specifici, va affiancata un’attività fisica adeguata ed eventualmente una terapia comportamentale.
La terapia farmacologica di supporto non è attualmente perseguibile perché i farmaci utilizzati per lungo tempo come anfetamine e sibutramina sono stati ritirati dal commercio e quindi non più disponibili nell'Unione Europea. L’utilizzo di interventi chirurgici (chirurgia bariatrica) è invece indicato solo in casi di particolare gravità, per quei pazienti che presentino obesità grave (con Bmi> 35-40) e altre patologie associate, che sono cioè ad alto rischio di mortalità, oppure che non rispondano agli altri trattamenti.
Titolo diapositiva
Scrivi qui la tua didascaliaPulsante

Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
Bulimia nervosa
La bulimia nervosa è caratterizzata da una tendenza frequente ad abbuffarsi, mangiando in modo eccessivo e sconsiderato. Successivamente alle abbuffate possono seguire rituali, punizioni e condotte di eliminazione che comportano anche ulteriori rischi per la salute.
Spesso, questi soggetti tendono anche ad abusare di farmaci, lassativi e prodotti dimagranti: il Dott. D’Andrea Federico è disponibile per colloqui dove si occuperà di presentare con maggiore precisione terapie e fattori di rischio.
- Leggi di più
A lungo andare, un soggetto bulimico entra in una fase di depressione e di disgusto verso se stesso e cerca di occultare il proprio comportamento agli altri, anche se la propria forma e apparenza fisica finiscono con il diventare una ossessione permanente e con l’avere forti ripercussioni sulla propria autostima.
Una persona bulimica può essere di peso normale, sottopeso o sovrappeso, diversamente da una anoressica che è sempre sotto peso. Inoltre, il peso di un soggetto bulimico può variare enormemente e oscillare, fatto che può essere utilizzato come sintomo dell’esistenza di un disordine alimentare.
Oltre all'anoressia e alla bulimia, esiste anche un genere di disordine alimentare non definito. Non tutti i casi sono infatti esattamente descrivibili nell'arco dei sintomi tipici di anoressia e bulimia. Alcuni soggetti, ad esempio, iniziano con una forma di anoressia ma poi, incapaci di mantenere il basso peso, scivolano verso comportamenti bulimici. Secondo l’American Psychiatric Association, la metà dei pazienti anoressici finiscono con l’avere anche sintomi di bulimia, e in qualche caso i pazienti bulimici sviluppano comportamenti anoressici.
Anoressia
L’anoressia è un disturbo della condotta alimentare caratterizzato da un rifiuto dell’alimentazione motivato dal timore di acquisire peso e ingrassare a dismisura. Le condotte di digiuno dei soggetti anoressici li portano tuttavia a essere estremamente sottopeso, anche dell’85% rispetto a quello normale, con gravi ripercussioni sulla salute.
Anche in questo caso il Dott. D’Andrea Federico è disponibile con incontri e consulenze per presentare terapie e fattori di rischio dell’anoressia.
- Le cause
Spesso, una persona anoressica comincia con l’evitare tutti i cibi ritenuti grassi e a concentrarsi su alimenti "sani" e poco calorici, con una attenzione ossessiva al contenuto calorico e alla composizione dei cibi e alla bilancia. Frequentemente i pasti vengono evitati o consumati con estrema lentezza, rimuginando a lungo su ogni boccone ingerito. Il corpo viene percepito e vissuto in modo alterato, con un eccesso di attenzione alla forma e con il rifiuto frequente ad ammettere la gravità della attuale condizione di sottopeso.
- La diagnosi
Diagnosticare l’anoressia non è sempre semplice in soggetti molto giovani, perché i cambiamenti fisici che accompagnano l’adolescenza e che comportano squilibri di peso e altezza possono mascherare le prime fasi. Nei bambini, è più comune che l’anoressia si manifesti attraverso altri sintomi, come la nausea e il sentimento di non fame. Nelle ragazze, invece, uno dei sintomi più classici è l’interruzione del ciclo mestruale per almeno tre mesi successivi, sintomo che però non si applica a giovani adolescenti che ancora non abbiano avuto il menarca o, al contrario, alle ragazze che prendono la pillola anticoncezionale.
- I sintomi
L’anoressia si manifesta in due modi:
- Con restrizioni, determinata dalla riduzione costante della quantità di alimenti ingeriti.
- Con abbuffate e successiva eliminazione: alimentazione compulsiva seguita da vomito autoindotto, uso inappropriato di pillole lassative e diuretiche, iperattività fisica per perdere peso.
La persona anoressica diventa così ossessionata dal cibo che la propria vita finisce con l’essere totalmente incentrata sulla questione alimentare, impedendo di provare interesse e entusiasmo verso qualsiasi altra cosa.

Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
Dislipidemie
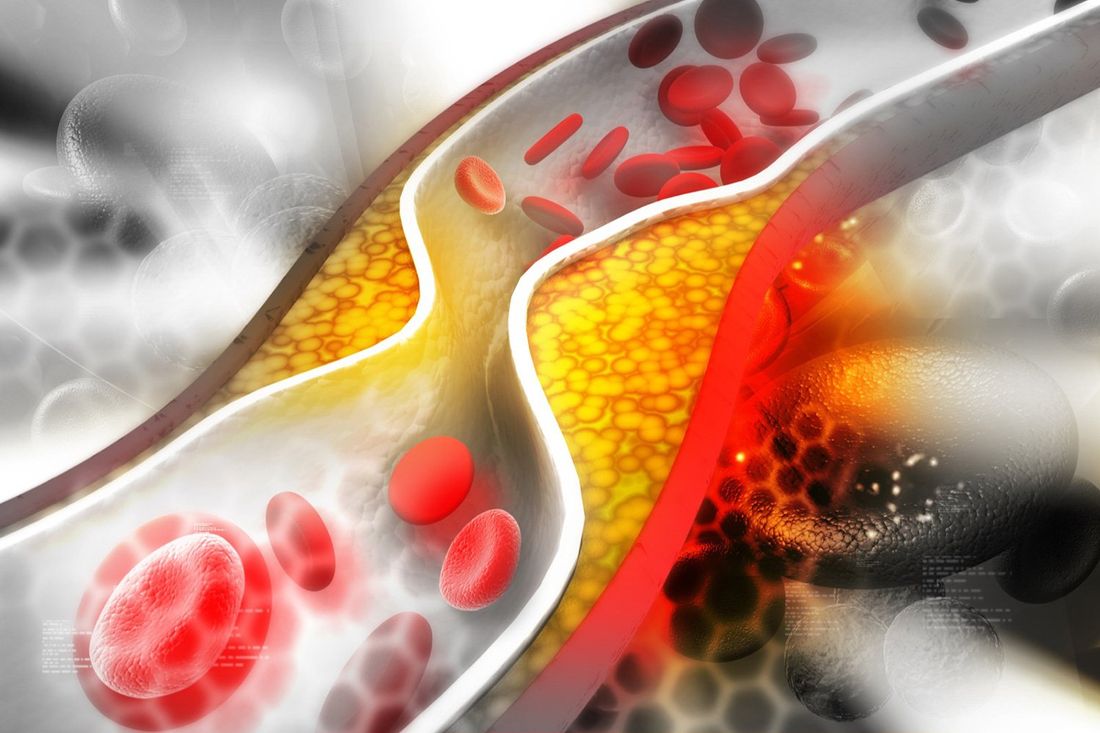
La dislipidemia è una patologia complessa, con cause spesso difficili da individuare con precisione, caratterizzata da una concentrazione elevata di lipidi nel sangue.
Si tratta di una patologia estremamente variegata con manifestazioni che possono variare da individuo a individuo.
- Fattori
Le dislipidemie sono uno dei principali fattori di rischio cardiovascolare. A seconda delle cause, le dislipidemie si distinguono tradizionalmente in primitive (su base genetica) e secondarie (o acquisite). Tra le secondarie si classificano anche quelle forme che, pur partendo da una predisposizione familiare, vedono come causa principale fattori legati all'alimentazione o a stili di vita errati. In questo caso si parla di dislipidemie multifattoriali.
- Sintomatologia
Indipendentemente dal fenotipo, la manifestazione principale della dislipidemie è l'aterosclerosi, soprattutto quando ad essere interessato dall'aumento dei livelli plasmatici è il colesterolo. L'aterosclerosi, che all'inizio può non dare sintomi, si manifesta in genere in epoca tanto più precoce quanto più grave è la dislipidemia. Più raramente si manifestano xantelasmi palpebrali o xantomi a livello della pelle (come sui gomiti o sul dorso).
Diabete
Il diabete è una malattia cronica caratterizzata dalla presenza di elevati livelli di glucosio nel sangue (iperglicemia) e dovuta a un’alterata quantità o funzione dell’insulina. L’insulina è l’ormone, prodotto dal pancreas, che consente al glucosio l’ingresso nelle cellule e il suo conseguente utilizzo come fonte energetica. Quando questo meccanismo è alterato, il glucosio si accumula nel circolo sanguigno.

Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
- Diabete di tipo 1
Riguarda circa il 10% delle persone con diabete e in genere insorge nell’infanzia o nell’adolescenza. Nel diabete tipo 1, il pancreas non produce insulina a causa della distruzione delle cellule ß che producono questo ormone: è quindi necessario che essa venga iniettata ogni giorno e per tutta la vita. La velocità di distruzione delle ß-cellule è, comunque, piuttosto variabile, per cui l’insorgenza della malattia può avvenire rapidamente in alcune persone, solitamente nei bambini e negli adolescenti, e più lentamente negli adulti (in questi rari casi si parla di una forma particolare, detta LADA: Late Autommune Diabetes in Adults).
La causa del diabete tipo 1 è sconosciuta, ma caratteristica è la presenza nel sangue di anticorpi diretti contro antigeni presenti a livello delle cellule che producono insulina, detti ICA, GAD, IA-2, IA-2ß. Questo danno, che il sistema immunitario induce nei confronti delle cellule che producono insulina, potrebbe essere legato a fattori ambientali (tra i quali, sono stati chiamati in causa fattori dietetici) oppure a fattori genetici, individuati in una generica predisposizione a reagire contro fenomeni esterni, tra cui virus e batteri. Quest’ultima ipotesi si basa su studi condotti nei gemelli monozigoti (identici) che hanno permesso di dimostrare che il rischio che entrambi sviluppino diabete tipo 1 è del 30-40%, mentre scende al 5-10% nei fratelli non gemelli e del 2-5% nei figli. Si potrebbe, quindi, trasmettere una “predisposizione alla malattia” attraverso la trasmissione di geni che interessano la risposta immunitaria e che, in corso di una banale risposta del sistema immunitario a comuni agenti infettivi, causano una reazione anche verso le ß cellule del pancreas, con la produzione di anticorpi diretti contro di esse (auto-anticorpi). Questa alterata risposta immunitaria causa una progressiva distruzione delle cellule ß, per cui l'insulina non può più essere prodotta e si scatena così la malattia diabetica.
Per questo motivo, il diabete di tipo 1 viene classificato tra le malattie cosiddette “autoimmuni”, cioè dovute a una reazione immunitaria diretta contro l’organismo stesso. Tra i possibili agenti scatenanti la risposta immunitaria, sono stati proposti i virus della parotite (i cosiddetti "orecchioni"), il citomegalovirus, i virus Coxackie B, i virus dell'encefalo miocardite. Sono poi in studio, come detto, anche altri possibili agenti non infettivi, tra cui sostanze presenti nel latte.
- Diabete tipo 2
È la forma più comune di diabete e rappresenta circa il 90% dei casi di questa malattia. La causa è ancora ignota, anche se è certo che il pancreas è in grado di produrre insulina, ma le cellule dell’organismo non riescono poi a utilizzarla. In genere, la malattia si manifesta dopo i 30-40 anni e numerosi fattori di rischio sono stati riconosciuti associarsi alla sua insorgenza. Tra questi: la familiarità per diabete, lo scarso esercizio fisico, il sovrappeso e l’appartenenza ad alcune etnie. Riguardo la familiarità, circa il 40% dei diabetici di tipo 2 ha parenti di primo grado (genitori, fratelli) affetti dalla stessa malattia, mentre nei gemelli monozigoti la concordanza della malattia si avvicina al 100%, suggerendo una forte componente ereditaria per questo tipo di diabete.
Anche per il diabete tipo 2 esistono forme rare, dette MODY (Maturity Onset Diabetes of the Young), in cui il diabete di tipo 2 ha un esordio giovanile e sono stati identificati rari difetti genetici a livello dei meccanismi intracellulari di azione dell’insulina.
Il diabete tipo 2 in genere non viene diagnosticato per molti anni in quanto l’iperglicemia si sviluppa gradualmente e inizialmente non è di grado severo al punto da dare i classici sintomi del diabete. Solitamente la diagnosi avviene casualmente o in concomitanza con una situazione di stress fisico, quale infezioni o interventi chirurgici.
Il rischio di sviluppare la malattia aumenta con l’età, con la presenza di obesità e con la mancanza di attività fisica: questa osservazione consente di prevedere strategie di prevenzione “primaria”, cioè interventi in grado di prevenire l’insorgenza della malattia e che hanno il loro cardine nell’applicazione di uno stile di vita adeguato, che comprenda gli aspetti nutrizionali e l’esercizio fisico.
- Diabete gestazionale
Si definisce diabete gestazionale ogni situazione in cui si misura un elevato livello di glucosio circolante per la prima volta in gravidanza. Questa condizione si verifica nel 4% circa delle gravidanze. La definizione prescinde dal tipo di trattamento utilizzato, sia che sia solo dietetico o che sia necessaria l’insulina e implica una maggiore frequenza di controlli per la gravida e per il feto.
- Segnali e sintomi
La sintomatologia di insorgenza della malattia dipende dal tipo di diabete. Nel caso del diabete tipo 1 di solito si assiste a un esordio acuto, spesso in relazione a un episodio febbrile, con sete (polidipsia), aumentata quantità di urine (poliuria), sensazione si stanchezza (astenia), perdita di peso, pelle secca, aumentata frequenza di infezioni.
Nel diabete tipo 2, invece, la sintomatologia è più sfumata e solitamente non consente una diagnosi rapida, per cui spesso la glicemia è elevata ma senza i segni clinici del diabete tipo 1.
- Diagnosi
I criteri per la diagnosi di diabete sono:
- Sintomi di diabete (poliuria, polidipsia, perdita di peso inspiegabile) associati a un valore di glicemia casuale, cioè indipendentemente dal momento della giornata, ≥ 200 mg/dl
- Glicemia a digiuno ≥ 126 mg/dl. Il digiuno è definito come mancata assunzione di cibo da almeno 8 ore.
- Glicemia ≥ 200 mg/dl durante una curva da carico (OGTT). Il test dovrebbe essere effettuato somministrando 75 g di glucosio.
Esistono, inoltre, situazioni cliniche in cui la glicemia non supera i livelli stabiliti per la definizione di diabete, ma che comunque non costituiscono una condizione di normalità. In questi casi si parla di Alterata Glicemia a Digiuno (IFG) quando i valori di glicemia a digiuno sono compresi tra 100 e 125 mg/dl e di Alterata Tolleranza al Glucosio (IGT) quando la glicemia due ore dopo il carico di glucosio è compresa tra 140 e 200 mg/dl. Si tratta di situazioni cosiddette di “pre-diabete”, che indicano un elevato rischio di sviluppare la malattia diabetica anche se non rappresentano una situazione di malattia. Spesso sono associati a sovrappeso, dislipidemia e/o ipertensione e si accompagnano a un maggior rischio di eventi cardiovascolari.
- Complicanze del diabete
Il diabete può determinare complicanze acute o croniche. Le complicanze acute sono più frequenti nel diabete tipo 1 e sono in relazione alla carenza pressoché totale di insulina. In questi casi il paziente può andare incontro a coma chetoacidosico, dovuto ad accumulo di prodotti del metabolismo alterato, i chetoni, che causano perdita di coscienza, disidratazione e gravi alterazioni ematiche.
Nel diabete tipo 2 le complicanze acute sono piuttosto rare, mentre sono molto frequenti le complicanze croniche che riguardano diversi organi e tessuti, tra cui gli occhi, i reni, il cuore, i vasi sanguigni e i nervi periferici.
- Retinopatia diabetica
La Retinopatia diabetica è un danno a carico dei piccoli vasi sanguigni che irrorano la retina, con perdita delle facoltà visive. Inoltre, le persone diabetiche hanno maggiori probabilità di sviluppare malattie oculari come glaucoma e cataratta.
- Nefropatia diabetica
Si tratta di una riduzione progressiva della funzione di filtro del rene che, se non trattata, può condurre all’insufficienza renale fino alla necessità di dialisi e/o trapianto del rene.
- Malattie cardiovascolari
Il rischio di malattie cardiovascolari è da 2 a 4 volte più alto nelle persone con diabete che nel resto della popolazione causando, nei Paesi industrializzati, oltre il 50% delle morti per diabete. Questo induce a considerare il rischio cardiovascolare nel paziente diabetico pari a quello assegnato a un paziente che ha avuto un evento cardiovascolare.
- Neuropatia diabetica
E' una delle complicazioni più frequenti e secondo l'Organizzazione Mondiale della Sanità si manifesta a livelli diversi nel 50% dei diabetici. Può causare perdita di sensibilità, dolore di diversa intensità e danni agli arti, con necessità di amputazione nei casi più gravi. Può comportare disfunzioni del cuore, degli occhi, dello stomaco ed è una delle principali cause di impotenza maschile piede diabetico: le modificazioni della struttura dei vasi sanguigni e dei nervi possono causare ulcerazioni e problemi a livello degli arti inferiori, soprattutto del piede, a causa dei carichi che sopporta. Questo può rendere necessaria l'amputazione degli arti e statisticamente costituisce la prima causa di amputazione degli arti inferiori di origine non traumatica.
- Complicanze in gravidanza
Nelle donne in gravidanza, il diabete può determinare conseguenze avverse sul feto, da malformazioni congenite a un elevato peso alla nascita, fino a un alto rischio di mortalità perinatale.
- Fattori di rischio
Le complicanze croniche del diabete possono essere prevenute o se ne può rallentare la progressione attraverso uno stretto controllo di tutti i fattori di rischio correlati.
Glicemia ed emoglobina glicata (HbA1c). Sono stati effettuati importanti studi clinici che hanno evidenziato l’importanza di un buon controllo metabolico per prevenire l’insorgenza di complicanze. I livelli medi di glicemia nel corso della giornata possono essere valutati mediante la misurazione dell’emoglobina glicata (HbA1c%). L’emoglobina, che è normalmente trasportata dai globuli rossi, può legare il glucosio in maniera proporzionale alla sua quantità nel sangue. In considerazione del fatto che la vita media del globulo rosso è di tre mesi, la quota di emoglobina cui si lega il glucosio sarà proporzionale alla quantità di glucosio che è circolato in quel periodo. Otteniamo, quindi, una stima della glicemia media in tre mesi. Nei soggetti non diabetici, il livello d’emoglobina glicata si mantiene attorno al 4-7 per cento, che significa che solo il 4-7 per cento di emoglobina è legato al glucosio. Nel paziente diabetico questo valore deve essere mantenuto entro il 7% per poter essere considerato in “buon controllo metabolico”
- Pressione sanguigna
Nei diabetici c’è un aumentato rischio di malattia cardiovascolari, quindi il controllo della pressione sanguigna è particolarmente importante, in quanto livelli elevati di pressione rappresentano già un fattore di rischio. Il controllo della pressione sanguigna può prevenire l’insorgenza di patologie cardiovascolari (malattie cardiache e ictus) e di patologie a carico del microcircolo (occhi, reni e sistema nervoso)
- Controllo dei lipidi nel sangue
Anche le dislipidemie rappresentando un aggiuntivo fattore di rischio per le patologie cardiovascolari. Un adeguato controllo del colesterolo e dei lipidi (HDL, LDL e trigliceridi) può infatti ridurre l’insorgenza di complicanze cardiovascolari, in particolare nei pazienti che hanno già avuto un evento cardiovascolare.
L’elevata frequenza di complicanze vascolari impone uno stretto monitoraggio degli organi bersaglio (occhi, reni e arti inferiori). Per questo, è necessario che le persone con diabete si sottopongano a periodiche visite di controllo, anche in assenza di sintomi.
- Interventi terapeutici
La terapia della malattia diabetica ha come cardine l’attuazione di uno stile di vita adeguato. Per stile di vita si intendono le abitudini alimentari, l’attività fisica e l’astensione dal fumo.
La dieta del soggetto con diabete (definita negli USA: Medical Nutrition Theraphy, cioè terapia medica nutrizionale) ha l’obiettivo di ridurre il rischio di complicanze del diabete e di malattie cardiovascolari attraverso il mantenimento di valori di glucosio e lipidi plasmatici e dei livelli della pressione arteriosa il più possibile vicini alla normalità.
In linea di massima, si raccomanda che la dieta includa carboidrati, provenienti da frutta, vegetali, grano, legumi e latte scremato, non inferiori ai 130 g/giorno ma controllando che siano assunti in maniera equilibrata, attraverso la loro misurazione e l’uso alternativo. Evitare l’uso di saccarosio, sostituibile con dolcificanti. Come per la popolazione generale, si raccomanda di consumare cibi contenenti fibre. Riguardo i grassi, è importante limitare il loro apporto a <7% delle calorie totali giornaliere, con particolare limitazione ai grassi saturi e al colesterolo.
Un’attività fisica di tipo aerobico e di grado moderato per almeno 150 minuti a settimana oppure di tipo più intenso per 90 minuti a settimana è raccomandata per migliorare il controllo glicemico e mantenere il peso corporeo. Dovrebbe essere distribuita in almeno tre volte a settimana e con non più di due giorni consecutivi senza attività. Come per la popolazione generale si consiglia di non fumare, e a tale scopo dovrebbe essere prevista una forma di sostegno alla cessazione del fumo come facente parte del trattamento del diabete.
I diabetici tipo 1 hanno necessità di regolare in maniera più stretta la terapia insulinica all’apporto dietetico e all’attività fisica, mentre per i diabetici tipo 2, che in genere sono anche sovrappeso o francamente obesi, assume maggior importanza un adeguato stile di vita che comprenda riduzione dell’apporto calorico, soprattutto dai grassi, e aumento dell’attività fisica per migliorare glicemia, dislipidemia e livelli della pressione arteriosa.

Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
Malnutrizione oncologica
La malnutrizione è l'insieme di alterazioni strutturali e funzionali dell'organismo causate da apporti in eccesso o in difetto (malnutrizione per eccesso o per difetto) di energia e/o di uno o più nutrienti.
Ha effetti negativi su prognosi, morbilità e mortalità. Può essere primaria o secondaria, la prima è caratterizzata da difetto di apporti di energia e/o di uno o più nutrienti e al di sotto delle necessità dell'organismo che non è causata da malattie concomitanti.
- Malnutrizione secondaria
La secondaria è conseguenza di riduzione di apporti collegata a malattie concomitanti.
Una forma di malnutrizione per difetto, definita proteico energetica, è quella in cui prevalgono carenze assolute o relative di energia e/o proteine. Questa tipologia è quella più frequente ed è quella oncologica.
La malnutrizione oncologica accompagna quasi costantemente la malattia neoplastica (interessa dal 20% al 50% dei pazienti) e ne condiziona spesso pesantemente la prognosi. Alcune neoplasie, soprattutto quelle del tratto gastroenterico (esofago, stomaco, intestino. Pancreas, fegato) sono caratterizzate da una frequente presenza di malnutrizione che può giungere sino alla cachessia, e determinare la morte prima delle cause oncologiche stesse.
- Prevenzione e terapia
La prevenzione e la terapia nutrizionale delle malnutrizione sono momenti fondamentali della terapia oncologica. Il paziente malnutrito vive di meno, ha una minore qualità di vita, risponde meno efficacemente alle terapie oncologiche, presenta più frequenti complicanze e maggiori necessità di ricoveri ospedalieri.
Ipertensione arteriosa
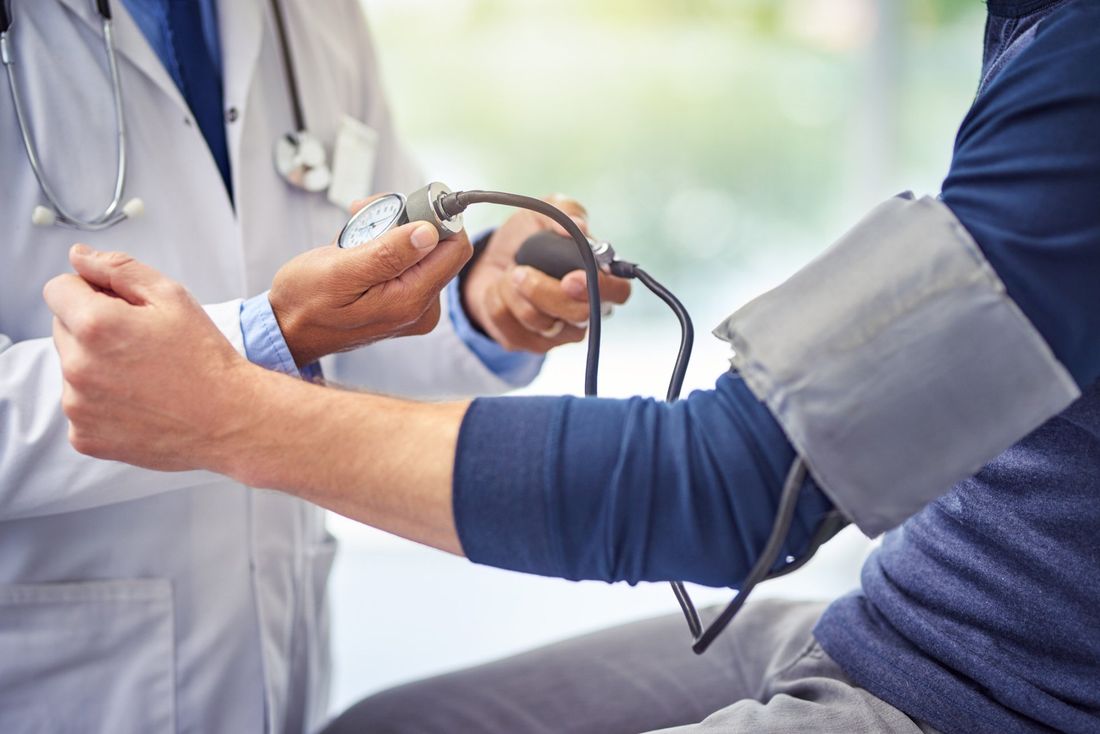
La pressione arteriosa è la forza esercitata dal sangue contro la parete delle arterie. A ogni battito del cuore, il sangue esce dal ventricolo sinistro attraverso la valvola aortica, passa nell'aorta, e si diffonde a tutte le arterie.
Quando il cuore si contrae e il sangue passa nelle arterie, si registra la pressione arteriosa più alta, detta ‘sistolica’ o ‘massima’; tra un battito e l’altro il cuore si riempie di sangue e all'interno delle arterie si registra la pressione arteriosa più bassa, detta ‘diastolica’ o ‘minima’.
- Misurazione
La misurazione della pressione si registra a livello periferico, usualmente al braccio e viene indicata da due numeri che indicano la pressione arteriosa sistolica e la diastolica, misurate in millimetri di mercurio (es. 120/80 mmHg).
Quando i valori di sistolica e/o di diastolica superano i 140 (per la massima) o i 90 (per la minima), si parla di ipertensione. Il valore della pressione arteriosa dipende in massima parte dalla adozione degli stili di vita fin dalla giovane età: mangiare con poco sale, molta frutta e verdura, camminare e non fumare mantengono la pressione arteriosa a livelli favorevoli nel corso della vita. Nel 90-95% dei casi l’ipertensione arteriosa non ha una causa evidente; questa forma viene dunque indicata come ‘ipertensione essenziale’.
- Sintomi
Nella maggior parte dei casi la pressione arteriosa elevata non dà sintomi; per questo l’ipertensione viene indicata come il ‘killer silenzioso’. In genere viene scoperta in occasione di un controllo dal medico o in farmacia. In caso di rialzo importante dei valori pressori (crisi ipertensiva, valori > 180/110 mmHg) può comparire una cefalea violenta, nausea, vomito, alterazioni della vista (restringimento del campo visivo, ‘lucine’ scintillanti, ecc...), vertigini e ronzii alle orecchie (acufeni) o ancora un’importante epistassi (emorragia dal naso).
- Fattori e terapie
L'Ipertensione arteriosa è una patologia molto frequente interessando una notevole percentuale di individui al di sopra dei 40 anni.
Il controllo dei fattori di rischio che sono correlati allo stile di vita sono estremamente importanti. In questo campo il ruolo della terapia dietetica appare fondamentale:
- Correzione del sovrappeso
- Correzione delle eventuali dislipidemie
- Controllo dell'apporto di sodio nella dieta (sale da cucina)
- Riduzione dell'apporto di bevande alcoliche
Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
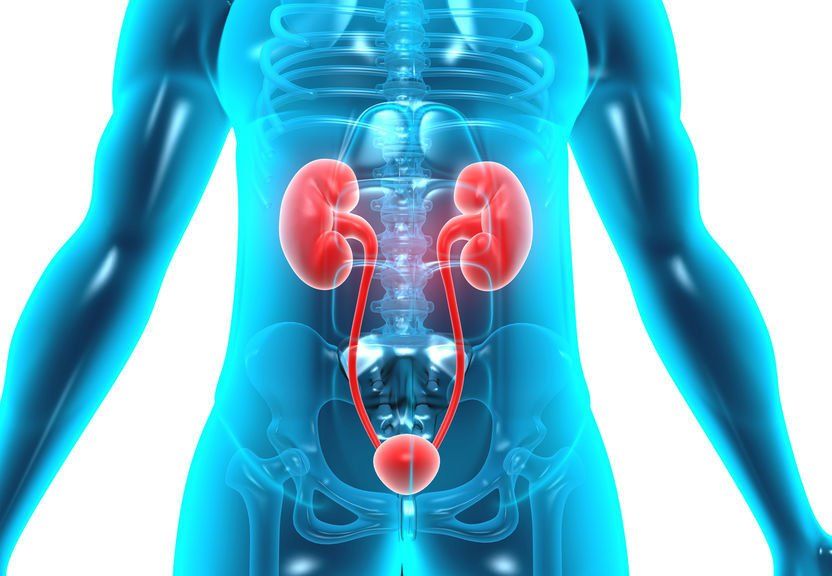
Insufficienza renale
L'insufficienza renale è una patologia associata alla riduzione della funzionalità renale. Spesso le insufficienze renali dell'età adulta sono la conseguenza di nefropatie dell'età evolutiva decorse in modo asintomatico e sottovalutate al momento delle prime manifestazioni cliniche, anche perché la sintomatologia non è specifica e tende ad una apparente attenuazione e successiva scomparsa.
- Le cause
Tra le cause più frequenti troviamo le infezioni urinarie ricorrenti, le nefropatie da reflusso urinario quali espressione di nefro-uropatia dell'età neonatale ed infantile; anche anomalie congenite quali il doppio distretto pielo-ureterale o la compressione da vasi anomali possono essere causa di infezioni renali recidivanti e conseguente insufficienza cronica. Quale causa di nefropatia vanno inoltre annoverate le faringotonsilliti ricorrenti dell'infanzia e dell'adolescenza. Nell'adulto troviamo infinite altre cause, ma citiamone alcune iatrogene che possono essere presenti anche nel periodo adolescenziale e cioè l'abuso di aspirina o di fenacetina o di altri FANS o l'utilizzazione di sali di litio; tra queste cause troviamo anche l'uso di stupefacenti e sostanze psicoattive. Vi sono poi cause metaboliche, genetiche, intossicazioni da metalli e malattie professionali.
- Categorie
Qualsiasi sia l'etiologia e la patogenesi si giunge infine all'insufficienza renale cronica (IRC) che può essere definita come una riduzione irreversibile e progressiva della funzionalità renale. Fisiologicamente viene rilevata dalla riduzione del flusso di filtrazione glomerulare, espresso come GFR Glomerular Filtration Rate (talvolta anche con l'italiano VFG Velocità di Filtrazione Glomerulare) e clinicamente da valori elevati di creatinina.
Può essere suddivisa in due categorie:
- Insufficienza Renale Acuta (IRA)
- Insufficianza Renale Cronica (IRC)
L'IRC è una patologia caratterizzata dalla riduzione graduale e irreversibile della funzionalità renale. Il grado della compromissione renale è inversamente proporzionale al numero residuo di nefroni funzionanti, per cui l'IRC può essere classificata in 5 stadi progressivi
- Gli stadi
Stadio 1
NEFROPATIA CRONICA, è la fase iniziale di ogni nefropatia cronica potenzialmente evolutiva, il GFR è normale o di poco aumentato.
Stadio 2
IRC LIEVE
Stadio 3
IRC MODERATA, si cominciano a manifestare i segni dello scompenso funzionale per quanto riguarda l'escrezione delle scorie azotate, contemporaneamente all'aumento dei valori di creatinina e azotemia.
Stadio 4
IRC GRAVE, oltre alla ritenzione azotata compaiono altre alterazioni biochimico-metaboliche.
Stadio 5
IRC TERMINALE, è detta anche fase uremica, con una marcata ritenzione idrica, a cui seguono numerose manifestazioni ematologiche cardiocircolatorie, nervose, endocrine, ossee.
In questa fase il paziente dovrà essere immediatamente preparato per passare alla terapia sostitutiva. Chi soffre di insufficienza renale (IRC), spesso può capitare che non si accorga di questa malattia fino a quando, almeno, la funzione dei reni non cessi totalmente, ed è necessario sottoporsi a trattamenti di emodialisi e/o trapianto di reni. La possibilità del trapianto renale va sempre esaminata con particolare attenzione e, una volta effettuato, pone problemi altrettanto complessi che vanno dalla scarsa funzionalità al rigetto, dalla necessità della scelta dei farmaci, allo stile di vita
- Alimentazione nel Paziente IRC
Qualsiasi sia la causa e lo stadio comunque valutato dell'IRC, l'alimentazione ha una importanza determinante per migliorare lo stato di nutrizione (spesso compromesso), per correggere le frequenti alterazioni elettrolitiche, per evitare le carenze vitaminiche etc. Come accennato in precedenza il rene ha anche una funzione endocrina in quanto produce eritropoietina, renina, prostaglandine, etc…; inoltre attiva la vitamina D che è importante in tutte le fasi della vita ma ancor di più nell'età evolutiva. D'altro canto numerosi studi condotti su pazienti uremici pongono in evidenza una malnutrizione che, nelle varie statistiche, va dal 20 al 50 %.
È pertanto importante:
- Valutare lo stato di nutrizione;
- Adeguare l'alimentazione allo stadio dell'IRC, alla fase dialitica, alle problematiche del soggetto che è stato sottoposto al trapianto.
L'alimentazione deve essere correlata allo stadio dell'IRC; in quella LIEVE è necessaria una dieta che controlli le patologie associate quali l'ipertensione arteriosa, il diabete, etc..; l'apporto proteico nelle 24 ore deve essere pari ad 1 g pro Kg di peso corporeo ideale e la dieta deve essere tale da ridurre gradualmente il peso se è in eccesso; il paziente si deve abituare al giusto apporto calorico e a praticare una moderata attività fisica, deve inoltre abolire il fumo, se fumatore, e ridurre l'apporto di sodio anche mediante la giusta scelta dei cibi.
Nell'IRC MODERATA l'apporto proteico deve essere ridotto a 0,8-0,6 g pro Kg di peso pro/die ma le proteine devono essere di alto valore biologico, almeno per il 60%, in quanto con l'assunzione di 0,6 g pro Kg di peso al dì siamo alla soglia della malnutrizione proteica.
Nell'IRC GRAVE, cioè con un VFG tra 5 e 25 ml/min, si ha una marcata acidosi ed una iperfosfatemia che vanno attentamente controllate; deve essere ridotto l'apporto di Na e controllato quello del K in particolare se si usano ACE inibitori.
L'apporto proteico deve essere di alto valore biologico e di 0,6 g pro Kg di peso ideale pro/die al fine di limitare l'accumulo di prodotti del catabolismo proteico e quindi controllare l'uremia.
Al di là dell'apporto in proteine, nella misura precedentemente indicata, la composizione della dieta suggerita nei pazienti con IRC deve essere tale che le calorie totali della giornata siano apportate dai glucidi per il 60 % rappresentati preferibilmente da zuccheri complessi e da alimenti a basso indice glicemico; i lipidi ne debbono costituire al massimo il 30 % con un rapporto acidi grassi polinsaturi/saturi > 1,2 e con un apporto di colesterolo di circa 300 mg/die; l'apporto in energia dovrebbe essere di circa 30 calorie per kg di peso corporeo al giorno con variazioni in relazione all'età del soggetto, alle sue possibilità di accrescimento staturale ed al valore dell'IMC (Indice di Massa Corporea). Ma molto spesso una dieta per quanto corretta, appropriata e personalizzata non è sufficiente ad ottenere questi risultati, tanto più se il grado dell'IRC costringe ad abbassare notevolmente la quota di proteine. In tal caso, per sopperire ad un insufficiente apporto calorico o a specifiche necessità non soddisfatte dalla dieta, è necessario ricorrere, in relazione allo stato clinico, nutrizionale e biochimico del paziente, ad integratori salino-vitaminici o a prodotti dietetici.
Celiachia
I casi di celiachia grave portano a caratteristici sintomi di feci biancastre, sciolte e grasse (steatorrea) e perdita di peso o mancato aumento di peso (nei bambini piccoli). Le persone affette da celiachia più lieve possono avere sintomi molto più sottili e che si possono presentare in altri organi, piuttosto che nell'intestino. È anche possibile essere affetti da celiachia ma non soffrire di alcun sintomo. Molti adulti con la malattia, accusano solo un po' di stanchezza o anemia.
- Sintomi gastrointestinali
La diarrea, caratteristica della malattia celiaca cronica, si presenta pallida, voluminosa e maleodorante. Possono essere presenti dolore addominale e crampi, gonfiore accompagnato da distensione addominale (si ritiene che ciò sia dovuto alla produzione fermentativa di gas intestinale) e ulcere della bocca.
Più l'intestino si danneggia, più si può sviluppare un certo grado di intolleranza al lattosio.
Spesso, i sintomi sono attribuiti alla sindrome dell'intestino irritabile (IBS) e solo in seguito vengono riconosciuti come propri della malattia celiaca. Ai pazienti che lamentano i sintomi propri della sindrome dell'intestino irritabile, viene proposto l'esame di screening per la celiachia.
La celiachia porta ad un aumento del rischio sia di sviluppare un’adenocarcinoma all'intestino tenue, che un linfoma al piccolo intestino (linfoma a cellule T associato a enteropatia).
Questo rischio diminuisce fino a livelli riscontrabili nella popolazione in generale, grazie ad una alimentazione appropriata. La malattia celiaca, se non trattata, può in un lungo periodo di tempo condurre ad ulteriori complicanze, come l'ulcerazione del digiuno un tratto dell'intestino tenue.
- Sintomi correlati al malassorbimento
I cambiamenti che avvengono nell'intestino, a causa della malattia, lo rendono meno capace di assorbire i nutrienti, i minerali e le vitamine liposolubili A, D, E e K.[2][38] L'incapacità di assorbire i carboidrati e i grassi può causare una perdita di peso (o una mancata o ritardata crescita nei bambini) e affaticamento. L'anemia può svilupparsi in diversi modi. Il malassorbimento del ferro può causare anemia da carenza di ferro e il malassorbimento dell'acido folico e della vitamina B12 può essere responsabile della anemia megaloblastica. Il malassorbimento di calcio e vitamina D (compensatio da iperparatiroidismo secondario) può causare osteopenia (una diminuzione del contenuto minerale delle ossa) o osteoporosi (indebolimento delle ossa e rischio di fratture da fragilità). Una piccola parte di pazienti sviluppa una anormale capacità di coagulazione per via della carenza di vitamina K e quindi risultano con un moderato rischio di sanguinamenti anomali. La celiachia è anche associata alla proliferazione batterica nell'intestino tenue, che può peggiorare il malassorbimento o causarlo nonostante l'adesione ad una dieta idonea.
- Sintomi vari
La celiachia è stato correlata con una serie di condizioni mediche. In molti casi, non è chiaro se i sintomi intestinali siano indotti dalla malattia o siano una predisposizione comune ad essa. Il deficit di IgA è presente nel 2,3% dei pazienti con malattia celiaca. A sua volta, questa condizione comporta un rischio dieci volte maggiore di sviluppare la malattia celiaca. La dermatite erpetiforme, una patologia cutanea pruriginosa, è stato collegata all'enzima transglutaminasi presente nella pelle. La malattia è considerata come una manifestazione cutanea della celiachia
La mancata o ritardata crescita può verificarsi anche in assenza di sintomi intestinali evidenti o di malnutrizione grave. Ricorrenti aborti spontanei e infertilità inspiegabile. Iposplenismo (milza piccola). Si verifica in circa un terzo dei casi e può predisporre a infezioni. Alterazione dei test di funzionalità epatica (rilevabile dalle analisi del sangue). Altre patologie associate, spesso autoimmuni, alla celiachia sono: diabete mellito di tipo 1, tiroidite autoimmune, cirrosi biliare primaria e colite microscopica.

Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
Malattia di Alzheimer
La demenza di Alzheimer ha, in genere, un inizio subdolo: le persone cominciano a dimenticare alcune cose, per arrivare al punto in cui non riescono più a riconoscere nemmeno i familiari e hanno bisogno di aiuto anche per le attività quotidiane più semplici. La demenza di Alzheimer oggi colpisce circa il 5% delle persone con più di 60 anni e in Italia si stimano circa 500mila ammalati.
- Storia
E’ la forma più comune di demenza senile, uno stato provocato da una alterazione delle funzioni cerebrali che implica serie difficoltà per il paziente nel condurre le normali attività quotidiane. La malattia colpisce la memoria e le funzioni cognitive, si ripercuote sulla capacità di parlare e di pensare ma può causare anche altri problemi fra cui stati di confusione, cambiamenti di umore e disorientamento spazio-temporale.
La malattia prende il nome da Alois Alzheimer, neurologo tedesco che per la prima volta nel 1907 ne descrisse i sintomi e gli aspetti neuropatologici. All’esame autoptico, il medico notò segni particolari nel tessuto cerebrale di una donna che era morta in seguito a una insolita malattia mentale. Infatti, evidenziò la presenza di agglomerati, poi definiti placche amiloidi, e di fasci di fibre aggrovigliate, i viluppi neuro-fibrillari. Oggi le placche formate da proteine amiloidi e i viluppi, vengono considerati gli effetti sui tessuti nervosi di una malattia di cui, nonostante i grossi sforzi messi in campo, ancora non si conoscono le cause.
Nei pazienti affetti da demenza di Alzheimer si osserva una perdita di cellule nervose nelle aree cerebrali vitali per la memoria e per altre funzioni cognitive. Si riscontra, inoltre, un basso livello di quelle sostanze chimiche, come l'acetilcolina, che lavorano come neurotrasmettitori e sono quindi coinvolte nella comunicazione tra le cellule nervose.
- Decorso e sintomi
Il decorso della malattia è lento e in media i pazienti possono vivere fino a 8-10 anni dopo la diagnosi della malattia.
La demenza di Alzheimer si manifesta con lievi problemi di memoria, fino a concludersi con grossi danni ai tessuti cerebrali, ma la rapidità con cui i sintomi si acutizzano varia da persona a persona. Nel corso della malattia i deficit cognitivi si acuiscono e possono portare il paziente a gravi perdite di memoria, a porre più volte le stesse domande, a perdersi in luoghi familiari, all’incapacità di seguire delle indicazioni precise, ad avere disorientamenti sul tempo, sulle persone e sui luoghi, ma anche a trascurare la propria sicurezza personale, l’igiene e la nutrizione.
I disturbi cognitivi possono, tuttavia, essere presenti anche anni prima che venga formulata una diagnosi di demenza di Alzheimer.
- Diagnosi
Oggi l’unico modo di fare una diagnosi certa di demenza di Alzheimer è attraverso l’identificazione delle placche amiloidi nel tessuto cerebrale, possibile solo con l’autopsia dopo la morte del paziente. Questo significa che durante il decorso della malattia si può fare solo una diagnosi di Alzheimer ‘possibile’ o ‘probabile’.
Per questo i medici si avvalgono di diversi test:
- Esami clinici, come quello del sangue, delle urine o del liquido spinale;
- Test neuropsicologici per misurare la memoria, la capacità di risolvere problemi, il grado di attenzione, la capacità di contare e di dialogare;
- Tac cerebrali per identificare ogni possibile segno di anormalità;
Questi esami permettono al medico di escludere altre possibili cause che portano a sintomi analoghi, come problemi di tiroide, reazioni avverse a farmaci, depressione, tumori cerebrali, ma anche malattie dei vasi sanguigni cerebrali.
Come in altre malattie neurodegenerative, la diagnosi precoce è molto importante sia perché offre la possibilità di trattare alcuni sintomi della malattia, sia perché permette al paziente di pianificare il suo futuro, quando ancora è in grado di prendere decisioni.
- Terapie farmacologiche
Oggi purtroppo non esistono farmaci in grado di fermare e far regredire la malattia e tutti i trattamenti disponibili puntano a contenerne i sintomi. Per alcuni pazienti, in cui la malattia è in uno stadio lieve o moderato, farmaci come tacrina, donepezil, rivastigmina e galantamina possono aiutare a limitare l’aggravarsi dei sintomi per alcuni mesi. Questi principi attivi funzionano come inibitori dell'acetilcolinesterasi, un enzima che distrugge l'acetilcolina, il neurotrasmettitore carente nel cervello dei malati di Alzheimer. Perciò inibendo questo enzima, si spera di mantenere intatta nei malati la concentrazione di acetilcolina e quindi di migliorare la memoria. Altri farmaci, inoltre, possono aiutare a contenere i problemi di insonnia, di ansietà e di depressione.
La messa a punto di nuovi farmaci per la demenza di Alzheimer è oggi un campo in grande sviluppo, nei laboratori di ricerca si sta lavorando a principi attivi che aiutino a prevenire, a rallentare la malattia e a ridurne i sintomi.
Altra via di ricerca attiva è quella che punta sullo sviluppo di una risposta immunologica contro la malattia cercando di sviluppare un vaccino in grado di contenere la produzione di b-amiloide (il peptide che si aggrega a formare le placche).
- Terapie non farmacologiche
Fra le varie terapie non farmacologiche proposte per il trattamento della demenza di Alzheimer, la terapia di orientamento alla realtà (ROT) è quella per la quale esistono maggiori evidenze di efficacia (seppure modesta). Questa terapia è finalizzata ad orientare il paziente rispetto alla propria vita personale, all’ambiente e allo spazio che lo circonda tramite stimoli continui di tipo verbale, visivo, scritto e musicale.
SLA Sclerosi Laterale Amiotrofica
La Sclerosi Laterale Amiotrofica, o SLA, è una grave malattia neurologica che colpisce la capacità di muoversi. E’ anche chiamata malattia di Lou Gehrig. La SLA colpisce le persone di tutte le razze e di tutti i gruppi etnici, colpisce soprattutto le persone tra i 40 e i 60 anni d’età e gli uomini sono più colpiti delle donne.
- Anatomia
Il cervello e il midollo spinale costituiscono il sistema nervoso centrale; i nervi del corpo, di braccia, gambe, petto, addome e pelvi costituiscono invece il sistema nervoso periferico. Il cervello è simile a un computer molto complesso che elabora gli stimoli provenienti dai nostri sensi e poi dice al corpo come rispondere, parlando o muovendosi.
Le cellule principali che costituiscono il cervello e il midollo spinale sono chiamate neuroni e sono di fatto le cellule pensanti del cervello. Esse comunicano tra di loro inviando segnali elettrici attraverso filamenti detti assoni. I neuroni che controllano i nostri muscoli sono chiamati motoneuroni. Gli assoni dei motoneuroni fanno contrarre i nostri muscoli e ciò ci aiuta ad adattarci al nostro ambiente parlando, camminando, masticando, correndo…
La SLA colpisce i neuroni che controllano i muscoli, i motoneuroni. I messaggi provenienti dai motoneuroni del cervello, chiamati motoneuroni superiori, sono trasmessi ai motoneuroni del midollo spinale, chiamati motoneuroni inferiori, poi sono trasmessi ai muscoli.
Con la SLA sia i motoneuroni superiori che inferiori muoiono e smettono di inviare messaggi ai muscoli.
- Cause
La causa della SLA non è nota, nel 90-95% dei casi si verifica in modo apparentemente casuale. La maggior parte dei pazienti con SLA non hanno una storia familiare della malattia, né i familiari hanno un rischio aumentato di sviluppare la SLA; solo il 5-10% di tutti i casi di SLA sembrano essere genetici. I ricercatori sono stati in grado di identificare il gene legato ad alcuni casi di SLA familiare e stanno cercando di sviluppare un trattamento. Alcuni ricercatori ipotizzano che la SLA si verifichi quando il sistema immunitario corporeo attacca i neuroni perché li ha confusi con cellule estranee.
- Sintomi
I sintomi della SLA di solito si manifestano gradualmente, inizialmente possono anche essere confusi con i sintomi di altre patologie meno gravi.I sintomi della SLA sono conseguenti alla distruzione dei motoneuroni, quindi i muscoli corrispondenti ai motoneuroni distrutti gradualmente si indeboliscono, deperiscono e si contraggono. I sintomi iniziali della SLA colpiscono le parti del corpo dove i motoneuroni vengono danneggiati per primi; in alcuni casi la SLA colpisce una sola gamba all’inizio, i soggetti notano di avere difficoltà mentre camminano o corrono, magari inciampando più spesso.
Altri pazienti notano i primi segni della SLA nella mano o nel braccio, notando che semplici compiti come abbottonarsi una camicia, scrivere o girare la chiave in una serratura diventano difficili. Altri pazienti ancora notano difficoltà nel parlare. La SLA causa una vasta gamma di disabilità, alla fine viene persa la capacità del cervello di controllare i movimenti volontari ed i pazienti perdono la forza e la capacità di muovere le braccia, le gambe e il corpo. Quando i muscoli nel diaframma e nella parete toracica non funzionano più, i pazienti con SLA non possono respirare senza il supporto di una macchina. La maggior parte delle persone con SLA si scontra con problemi respiratori entro 3-5 anni dall’esordio della malattia. Poiché la SLA colpisce solo i motoneuroni, la patologia non altera la personalità, l’intelligenza o la memoria. La SLA non interferisce inoltre con la vista, l’olfatto, il gusto, l’udito o il tatto. I pazienti con SLA di solito mantengono il controllo dei muscoli oculari, della vescica e delle funzioni intestinali.
- Diagnosi
Un neurologo di solito diagnostica la SLA dopo aver esaminato la storia medica molto attentamente ed aver fatto un esame fisico.
Spesso è difficile fare diagnosi di SLA precocemente, poiché essa può essere confusa con altre patologie come tumori del midollo spinale, sclerosi multipla o compressione dei nervi. Quando i sintomi della SLA progrediscono diventa invece più facile arrivare alla diagnosi. La SLA può essere diagnosticata usando test elettrici su muscoli e nervi, questi test sono chiamati EMG e NCV, cioè elettromiogramma e velocità di conduzione nervosa. Alcuni esami sul midollo spinale ottenuti eseguendo una puntura lombare possono escludere altre malattie e indirizzare alla SLA.
La scansioni MRIs e CAT aiutano ad escludere malattie diverse dalla SLA che potrebbero essere causa dei sintomi.
- Cura e Terapia
Non c’è nessuna cura definitiva per la SLA. E’ stato recentemente approvato dalla Food And Drug Administration, una sorta di Ministero della Salute Americano, il primo trattamento medico per la SLA; i ricercatori ritengono che il riluzolo (questo il nome della sostanza) riduca il danno ai motoneuroni. Sembra poi in grado di aumentare la sopravvivenza di diversi mesi, soprattutto nei pazienti che hanno difficoltà a deglutire. E’ bene sottolineare che il riluzolo non fa regredire il danno pre-esistente ai motoneuroni, permette quindi solo di rallentare la progressione e non di migliorare il quadro clinico preesistente. Gli altri trattamenti per la SLA alleviano i sintomi e migliorano la qualità di vita del paziente; per fornire questa terapia si forma in genere un team di diversi professionisti comprendente medici, farmacisti, terapeuti, assistenti sociali e specialisti di case di cura. Lavorando con i pazienti il team medico può elaborare un piano individuale di terapie mediche e fisiche, fornendo eventualmente l’attrezzatura per mantenere i pazienti quanto più mobili e comodi possibile.
I medici possono prescrivere farmaci per ridurre:
- Fatica,
- Crampi muscolari,
- Saliva in eccesso,
- Catarro.
Sono disponibili inoltre farmaci per aiutare i pazienti con SLA con dolore, depressione, problemi di sonno e stipsi. I pazienti con SLA che hanno difficoltà a parlare possono trarre beneficio dal lavoro con un logopedista. La terapia fisica e speciali attrezzature o dispositivi come rampe, bracciali, camminatori, sedie a rotelle possono aiutare i pazienti con SLA a mantenere la loro indipendenza e a rimanere mobili. Quando i pazienti non possono più ricevere abbastanza nutrimento mangiando, può essere inserito nello stomaco un sondino, riducendo il rischio di soffocamento. Il sondino riduce anche il rischio di polmonite che potrebbe derivare dall’inalazione di cibo o bevande nei polmoni. Il sondino non è doloroso e non impedisce al paziente di mangiare con la bocca.
Quando i muscoli respiratori si indeboliscono, può essere usata di notte una macchina per la respirazione assistita durante il sonno. Con il progredire della malattia può essere necessaria la macchina per far gonfiare e sgonfiare i polmoni per tutto il tempo (respiratore). Gli operatori sociali, gli infermieri e gli specialisti delle casa di cura aiutano ad affrontare le sfide mediche, emotive e finanziarie della SLA, specialmente durante le fasi finali.

Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
Malattia di Crohn
La malattia di Crohn o morbo di Crohn, nota anche come enterite regionale, è una malattia infiammatoria cronica dell'intestino(MICI) che può colpire qualsiasi parte del tratto gastrointestinale, dalla bocca all'ano, provocando una vasta gamma di sintomi.
- Sintomi
Essa causa principalmente dolori addominali, diarrea (che può anche essere ematica se l'infiammazione è importante), vomito o perdita di peso, ma può anche causare complicazioni in altri organi e apparati, come eruzioni cutanee, artriti, infiammazione degli occhi, stanchezza e mancanza di concentrazione
La malattia di Crohn è considerata una malattia autoimmune, in cui il sistema immunitario aggredisce il tratto gastrointestinale provocando l'infiammazione, anche se viene classificata come un tipo particolare di patologia infiammatoria intestinale. Ci sono prove di una predisposizione genetica per la malattia e questo porta a considerare gli individui con fratelli ammalati tra gli individui ad alto rischio
La malattia di Crohn tende a presentarsi inizialmente negli adolescenti e nei ventenni, con un altro picco di incidenza tra i cinquanta e i settant'anni, anche se la malattia può manifestarsi a qualsiasi età.
- Terapie
Non esiste ancora una terapia farmacologica risolutiva o una terapia chirurgica eradicante la malattia di Crohn. Le possibilità di trattamento sono limitate al controllo dei sintomi, al mantenimento della remissione e alla prevenzione delle ricadute.
La malattia prende il nome dal gastroenterologo statunitense Burrill Bernard Crohn che, nel 1932, insieme a due colleghi, ha descritto, per primo, una serie di pazienti con infiammazione dell'ileo terminale, solitamente la zona più colpita dalla malattia. Per questo motivo, la malattia è stata anche chiamata ileite regionale o enterite regionale.
Rettocolite Ulcerosa
La rettocolite ulcerosa è una malattia infiammatoria cronica intestinale che coinvolge selettivamente la mucosa del retto e/o del colon, nella maggioranza dei casi la parte discendente.
- Anatomia patologica
La rettocolite ulcerosa interessa il retto e può estendersi in senso retrogrado fino a coinvolgere l'intero colon nei casi più gravi dando un quadro di pancolite. La mucosa appare macroscopicamente arrossata, granulare, friabile e facilmente sanguinante; nella fase conclamata con grave infiammazione si osservano numerose e ampie ulcerazioni della mucosa del colon. Infatti la flogosi porta ad una dilatazione dei vasi sanguigni con emorragie. D'altra parte invece a livello delle lesioni i vasi sanguigni sono compressi per la dilatazione del lume del colon (dovuta all'assenza di peristalsi a causa delle lesioni che interessano i plessi nervosi). La compressione di questi vasi porta ad un quadro di necrosi che rende la mucosa ancora più fragile. Inoltre l'assenza di peristalsi e la compressione dei vasi sanguigni porta a fenomeni di malassorbimento. Si formano isole di epitelio che protrudono nel lume chiamate pseudopolipi; questi sono dovuti alla rigenerazione dell'epitelio in seguito alla flogosi e pertanto non sono neoplastici. Non si osserva un ispessimento della parete o alterazione della membrana sierosa a differenza del morbo di Crohn, altra malattia facente parte delle malattie infiammatorie croniche intestinali idiopatiche. Nei casi più gravi si ha una perdita della funzione neuromuscolare a causa di un danno alla tonaca muscolare e ai plessi nervosi, ciò porta ad una situazione molto grave di megacolon tossico in cui si osserva una progressiva gangrena e dilatazione dell'organo. All'esordio della malattia si osserva una criptite caratterizzata da un infiltrato infiammatorio prevalentemente mononucleato nella lamina propria; successivamente granulociti neutrofili possono infiltrare l'epitelio formando raccolte nel lume delle cripte causando ascessi criptici. Non si rilevano granulomi, che invece sono specifici del morbo di Crohn, anche se la rottura degli ascessi criptici possono causare nella lamina propria una reazione da corpo estraneo. Col progredire della patologia si formano ulcerazioni che si estendono nella sottomucosa che a volte mettono a nuda la tonaca muscolare, con la remissione della fase attiva questi crateri si riempiono di tessuto di granulazione e il tessuto mucoso si rigenera. Rimangono però fibrosi sottomucosa, atrofia della mucosa e disorganizzazione dell'architettura normale. Questo processo può portare a displasia dell'epitelio, favorendo la progressione al carcinoma.
- Sintomatologia
La causa della SLA non è nota, nel 90-95% dei casi si verifica in modo apparentemente casuale. La maggior parte dei pazienti con SLA non hanno una storia familiare della malattia, né i familiari hanno un rischio aumentato di sviluppare la SLA; solo il 5-10% di tutti i casi di SLA sembrano essere genetici. I ricercatori sono stati in grado di identificare il gene legato ad alcuni casi di SLA familiare e stanno cercando di sviluppare un trattamento. Alcuni ricercatori ipotizzano che la SLA si verifichi quando il sistema immunitario corporeo attacca i neuroni perché li ha confusi con cellule estranee.

Titolo diapositiva
Scrivi qui la tua didascaliaPulsante

Titolo diapositiva
Scrivi qui la tua didascaliaPulsante
Morbo di Parkinson
La malattia di Parkinson sovente definita come morbo di Parkinson, Parkinson, parkinsonismo idiopatico, parkinsonismo primario, sindrome ipocinetica rigida o paralisi agitante è una malattia degenerativa del sistema nervoso centrale. I sintomi motori tipici della condizione sono il risultato della morte delle cellule che sintetizzano e rilasciano la dopamina. Tali cellule si trovano nella substantia nigra, una regione del mesencefalo.
La causa che porta alla loro morte è sconosciuta.
- Cause e Sintomi
All'esordio della malattia, i sintomi più evidenti sono legati al movimento, ed includono tremori, rigidità, lentezza nei movimenti e difficoltà a camminare. In seguito, possono insorgere problemi cognitivi e comportamentali, con la demenza che si verifica nelle fasi avanzate. La malattia di Parkinson è più comune negli anziani, la maggior parte dei casi si verifica dopo i 50 anni.
I sintomi motori principali sono comunemente chiamati parkinsonismo. La condizione è spesso definita come una sindrome idiopatica anche se alcuni casi atipici hanno un'origine genetica. Molti fattori di rischio e fattori protettivi sono stati indagati: la prova più evidente è l'aumento del rischio di malattia nelle persone esposte a determinati pesticidi e un ridotto rischio nei fumatori di tabacco. La patologia è caratterizzata dall'accumulo di una proteina, chiamata alfa-sinucleina, in inclusioni denominate corpi di Lewy nei neuroni e dall'insufficiente formazione di dopamina. La distribuzione anatomica dei corpi di Lewy è spesso direttamente correlata all'espressione e al grado dei sintomi clinici di ciascun individuo.
- Diagnosi
La diagnosi nei casi tipici si basa principalmente sui sintomi, con indagini di neuro imaging come conferma. I moderni trattamenti sono efficaci per gestire i sintomi motori precoci della malattia, grazie all'uso di agonisti della dopamina e del levodopa. Col progredire della malattia, i neuroni dopaminergici continuano a diminuire di numero, e questi farmaci diventano inefficaci nel trattamento della sintomatologia e, allo stesso tempo, producono una complicanza, la discinesia, caratterizzata da movimenti involontari. Una corretta alimentazione e alcune forme di riabilitazione hanno dimostrato una certa efficacia nell'alleviare i sintomi. La chirurgia e la stimolazione cerebrale profonda vengono utilizzate per ridurre i sintomi motori come ultima risorsa, nei casi più gravi in cui i farmaci risultano inefficaci.
La malattia prende il nome dal medico inglese James Parkinson, che pubblicò la prima descrizione dettagliata nel suo trattato An Essay on the Shaking Palsy nel 1817.
- Epidemiologia
La malattia di Parkinson è la seconda malattia neurodegenerativa più comune dopo la malattia di Alzheimer. La prevalenza della condizione nei paesi industrializzati è di circa lo 0,3%. La malattia di Parkinson è più comune negli anziani e la prevalenza aumenta dall'1% in quelli oltre i 60 anni di età, fino al 4% della popolazione sopra gli 80 anni. L'età media di insorgenza è circa 60 anni, anche se il 5-10% dei casi, classificati come ad esordio giovane, iniziano tra i 20 e i 50 anni. La malattia risulterebbe essere meno diffusa nelle popolazioni di origineafricana e asiatica, sebbene questo dato sia contestato. Alcuni studi hanno proposto che sia più comune negli uomini rispetto alle donne, ma altri non hanno rilevato particolari differenze tra i due sessi. L'incidenza della malattia di Parkinson è tra 8 e 18 per 100 000 persone-anno.
Per conoscere tutte le patologie curate dal Dietologo Nutrizionista Clinico Dott. D'Andrea Federico, contatta lo studio





